
FRA LMI: Hege Edvardsen 
Avanserte terapier inkluderer genterapi, celleterapi og vevsterapi 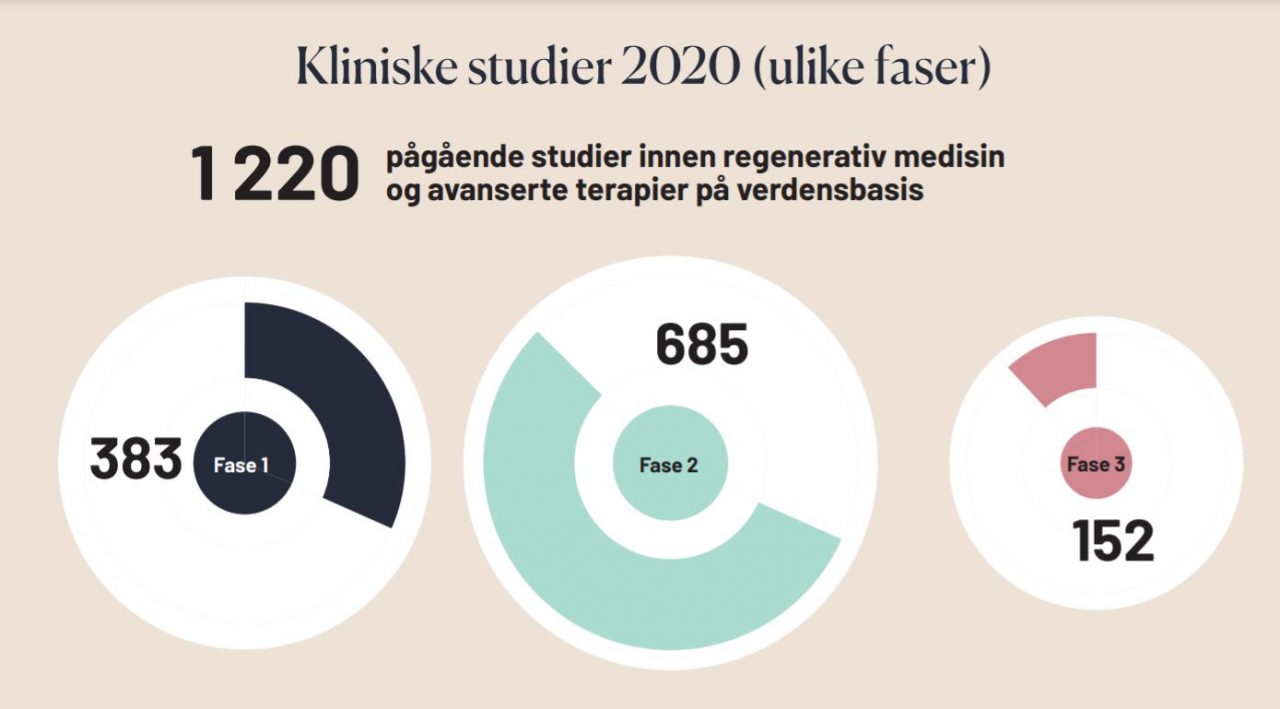
Kliniske studier på avanserte terapier
– Bakgrunnen for møteserien er at vi sammen så et felles behov for å øke vår alles kunnskap om hva Advanced Therapy Medicinal Products – eller avanserte terapier er, både hos oss i som jobber i legemiddelindustrien, hos embetsverket, beslutningstakere, klinikere, akademikere, pasientene og allmenheten, sa seniorrådgiver i LMI, Hege Edvardsen, da hun åpnet det aller første av i alt åtte møter.
– Avanserte terapier, som genterapier og celleterapier, er jo noe av det mest spennende som skjer innen medisinsk innovasjon for tiden, sa Sigrid Bratlie, seniorrådgiver i Kreftforeningen.

– Og det er vanskelig å ikke bli begeistret – som pasientene også blir – når man hører stadige eksempler på ting som nesten høres ut som science fiction, men som er i ferd med å bli virkelighet. Det at muskelsyke barn, som i utgangspunktet er ubevegelige, plutselig kan sitte og spise på egenhånd. Eller pasienter som har blitt nesten blinde på grunn av en genetisk øyesykdom, begynner å se igjen. Det er jo helt fantastisk. Og det er innen kreftbehandling at denne utviklingen går aller raskest, med celleterapi – eller immunterapi 2.0, som jeg kaller det. Det har allerede reddet mange liv, så det er en veldig spennende framtid vi går i møte, sa Bratlie.
Men hva er egentlig avanserte terapier, og hva er det ikke? Hvordan ligger Norge an når det gjelder å godkjenne ATMP, hvordan kan norske pasienter delta i kliniske studier innen ATMP, og hvordan betaler man for disse terapiene? Dette er noen av spørsmålene møteserien skal gi svar på. Det første ble holdt i LMIs lokaler på Majorstuen, og de påfølgende møtene skal holdes delvis der og delvis hos Legemiddelverket på Helsfyr, med følgende temaer:
- Hva er ATMP?
- Car-T og genterapi
- Celle- og vevsterapi
- Norges ambisjoner innen ATMP
- Fra forskning til bruk i Norge
- Veien fra fabrikk til pasient
- Trenger banebrytende innovasjon innovative finansieringsmodeller?
- Hvordan ser fremtiden ut, og er etikken om rammene samkjørte?
Avanserte terapier, eller ATMP, representerer altså en forholdsvis ny type behandlinger som per i dag har blitt godkjent for et utvalg sykdomsområder, innenfor kreftbehandling, øyesykdommer og arvelige nevrologiske sykdommer.
– Men det er også et område hvor vi ser at det er en stor utvikling på gang med mange kliniske studier underveis og hvor vi forventer å se mange flere behandlinger bli godkjent fremover, sa Edvardsen.
Finnes tre typer ATMP
Rune Kjeken, fagdirektør i Statens legemiddelverk, tok seg av den første delen av opplærlingen.

– Det finnes tre typer ATMPer; genterapi, somatisk celleterapi og vevsterapi, forklarte Rune Kjeken. -Til sammen utgjør dette mange ulike produkttyper, alt fra nokså «enkle» produkter, som kondrocytter man sprøyter inn i kneet for å reparere bruskskader, til svært avansert organprinting. Men vi regulerer altså dette som legemidler, på samme måte som enkle molekyler som aspirin, eller litt mer komplekse biologiske produkter, som insulin eller monoklonale antistoffer. Så går det en gradient fra enkle kjemiske legemidler, til genterapi, celleterapi og svært komplekse former for vevsterapi. Et kriterium for at det skal kunne kalles avanserte terapier er at det skal være gjort noe med cellene eller vevet skal være «manipulert» på en slik måte at det kan endre karakteristiska eller fenotype. Et annet kriterium er at cellene man høster ikke blir brukt til den samme funksjonen hos den som mottar produktet, sa Kjeken.
Se PP-presentasjonen til Rune Kjeken
Hvis man høster fettceller fra en pasient, f.eks. fra rumpa, og bruker det f.eks. på Radiumhospitalet til brystkreftpasienter for sårheling osv., og dette skjer i samme operasjonssal uten at man dyrker cellene, så er det ikke ATMP. Men tar man ut fettceller og dyrker dem, og deretter bruker dem til en helt annen funksjon enn de opprinnelig ble brukt, så er det ATMP, forklarte han.
14 godkjente avanserte terapier
Kjeken understreket at ATMP verken bør overreguleres, slik at det blir vanskelig å utvikle nye legemidler– eller underreguleres, slik at man f.eks. åpner for bruk av stamcelleterapi uten dokumentert sikkerhet og effekt, og som i noen land tilbys til alt fra Alzheimers sykdom til erektil dysfunksjon.
– Så langt er det godkjent 14 avanserte terapier, hvorav ca 5 det siste året. Én av disse er celleterapi, to er vevsterapier og resten er genterapier – men da mange cellebaserte genterapier, blant annet CAR-T for kreft. Det er en ganske robust pipeline innen genterapi. En analyse fra MIT antar at det kommer minst 40-60 nye genterapier fram til 2030, og minst 500 000 pasienter som behandles med genterapi innen den tid, sa Kjeken.
Fra regulatorisk side ser man viktigheten av å gi regulatorisk støtte til utviklingen av ATMP. I EMA har man innført PRIME (PRIority MEdicines), et system som skal hjelpe til med å få fram nye, innovative legemidler, og rundt 50% av disse er ATMP’er.
– Genterapier kan administreres direkte i kroppen (in vivo) eller ved at man tar ut celler, genmodifiserer disse (ex vivo), før de tilbakeføres til pasienten.
Særlig for kreft er utvikles det mange cellebaserte genterapier.
– Det er nok den type produkter vi kommer til å se mest av og som vil ha mest allmenn interesse. De færreste av oss har en sjelden genetisk sykdom, men mange av oss får kreft. Og mest sannsynlig vil flere av oss behandles med genterapi. Det var ikke noe jeg tenkte på for 10 år siden at jeg kom til å få genterapi selv, men det er slettes ikke umulig, sa Kjeken.
Nyfødtscreening viktig
Når det gjelder genterapi for medfødte genetiske sykdommer, er det viktig å oppdage disse tidlig for å kunne gi effektive behandling. Det er lettere å redde gjenværende funksjon, enn å gjenopprette skade som allerede har skjedd.
– Det er viktig at vi i Norge får på plass et bedre system for nyfødtscreening slik at vi kan implementere ting mye raskere enn det vi gjør i dag. Det er også viktig for å kunne tiltrekke seg kliniske studier på dette feltet. Det er alt for sent å implementere det to år etter at vi har godkjent nye terapier. Så et system for det, vil være viktig for pasienter, sa Kjeken.
-Kjeken forklarte også litt om EMAs vitenskapelige komité for avanserte terapier, CAT (Comittee for Advanced Therapies), som følger hele utviklingsløpet for ATMP’er fra regulatorisk side. CAT gjøre klassifisering og sertifisering av disse produktene, de gir vitenskapelige råd til utviklere, og de er ansvarlig for å godkjenne søknader om markedsføringstillatelse og å følger opp etter markedsføringstillatelse.
– Og så skriver vi guidelines, – og jobber med internasjonal harmonisering sammen med FDA og andre. Det er viktig særlig for sjeldenfeltet at man har et harmonisert regelverk slik at det er mulig å gjøre kliniske studier i ulike land, med samme design, og at man kan ha et større marked, for det trenger man for at disse terapiene skal være økonomisk bærekraftig, sa Kjeken.
Det er en strøm av ulike avanserte terapier på vei, og mange kliniske studier på gang. Kreftforeningen har gått inn i et 50 millioner kroners spleiselag for å etablere Senter for avansert celleterapi – et nasjonalt senter som skal ligge ved Oslo universitetssykehus. Målet er å få lovende konsepter raskere inn i kliniske studier for norske pasienter, fortalte Sigrid Bratlie.

EU har vedtatt en ny forordning for kliniske studier, som trer i kraft 31. januar 2022. Målet med denne er blant annet å harmonisere reglene for saksbehandling og gjennomføring av klinisk utprøving i Europa, å ha en høy standard for sikkerheten til studiedeltagere, samt øke åpenhet om klinisk utprøving i Europa. En ønsket gevinst er økt antall utprøvinger i Europa.
Ingvild Aaløkken, seniorrådgiver Legemiddelverket, fortalte litt om hva det medfører og hvilke konsekvenser det får for ATMPer.
Se PP-presentasjonen til Aaløkken her
Aaløkken ledet også et møte med industrien tidligere i høst, der hun og kollegene svarte på en rekke praktiske spørsmål om forordningen.
Les spørsmålene og svarene her:
Q&A om felles digitalt saksbehandlingssystem for klinisk utprøving