Første gang publisert 23. november 2020.
Sist oppdatert: 26. august 2021
Siden koronapandemien startet i januar 2020 er over 214 millioner mennesker smittet av viruset og over 4,4 millioner er døde, ifølge tall fra Verdens helseorganisasjon. I Norge har viruset tatt 811 liv, ifølge Folkehelseinstituttet. Vaksiner mot viruset er utviklet på rekordtid, takket være et unikt samarbeid og en enorm innsats, og det produseres på spreng for å gi verdenssamfunnet tryggheten tilbake i hverdagen.
Den 21. desember 2020 ble den første vaksinen godkjent av EU, snaut ett år etter at viruset ble oppdaget: Pfizer og BioNTechs Comirnaty. Siden har tre andre vaksiner kommet etter: Modernas vaksine Spikevax (som først hadde det midlertidige navnet Covid-19 Vaccine Moderna), AstraZeneca/Oxford Universitys vaksine Vaxzevria (som først hadde det midlertidige navnet Covid-19 Vaccine Astra Zeneca) og Janssens vaksine Vaccine Janssen.
I tillegg er nå (per august 2021) fem vaksiner under såkalt rolling review hos europeiske legemiddelmyndigheter, EMA. Blant dem er vaksinen til Sanofi Pasteur.
I Norge er vaksinene fra AstraZeneca og Janssen tatt ut av vaksinasjonsprogrammet, etter meldinger om sjeldne, men alvorlige bivirkninger.
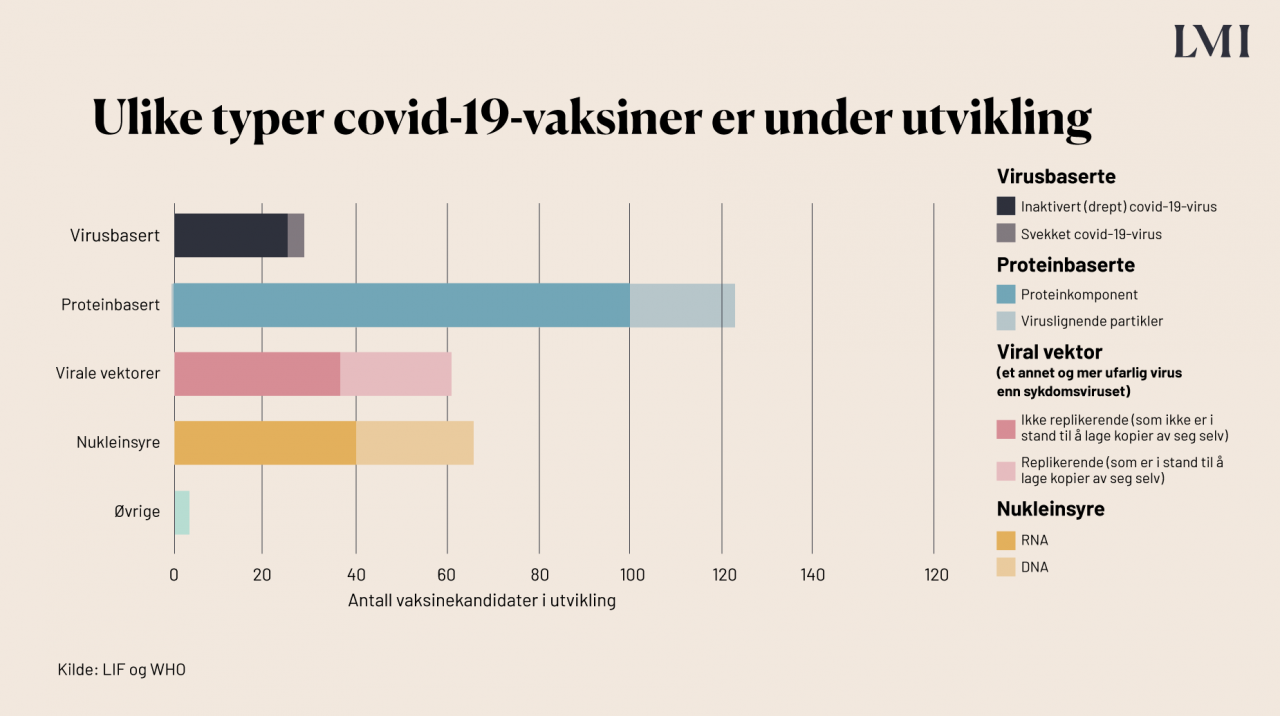
Hvilke typer vaksiner er under utvikling?
Flere ulike teknologier og plattformer prøves ut i de ulike prosjektene. Noen av vaksinene bruker kjent teknologi, mens andre bruker teknologi som ikke er brukt i vaksiner tidligere. Vaksinetypene kan deles inn i fire grupper: virusbaserte, proteinbaserte, virale vektorer og nukleinsyrebaserte vaksiner (DNA- og RNA-vaksiner). Den sistnevnte teknologien er relativt ny. Statistikken viser at det er flest proteinbaserte vaksiner under utvikling mot covid-19, men av de tre som er godkjent er to RNA-vaksiner og to ikke-replikerende viral vektor-vaksine.
Hvilke vaksiner bruker hvilken teknologi?
Moderna og Pfizer/BioNTech har utviklet RNA-vaksiner (nukleinsyre), mens AstraZeneca/Universitetet i Oxford og Janssen/Johnson&Johnson har utviklet viral vektor-vaksiner, ikke-replikerende.
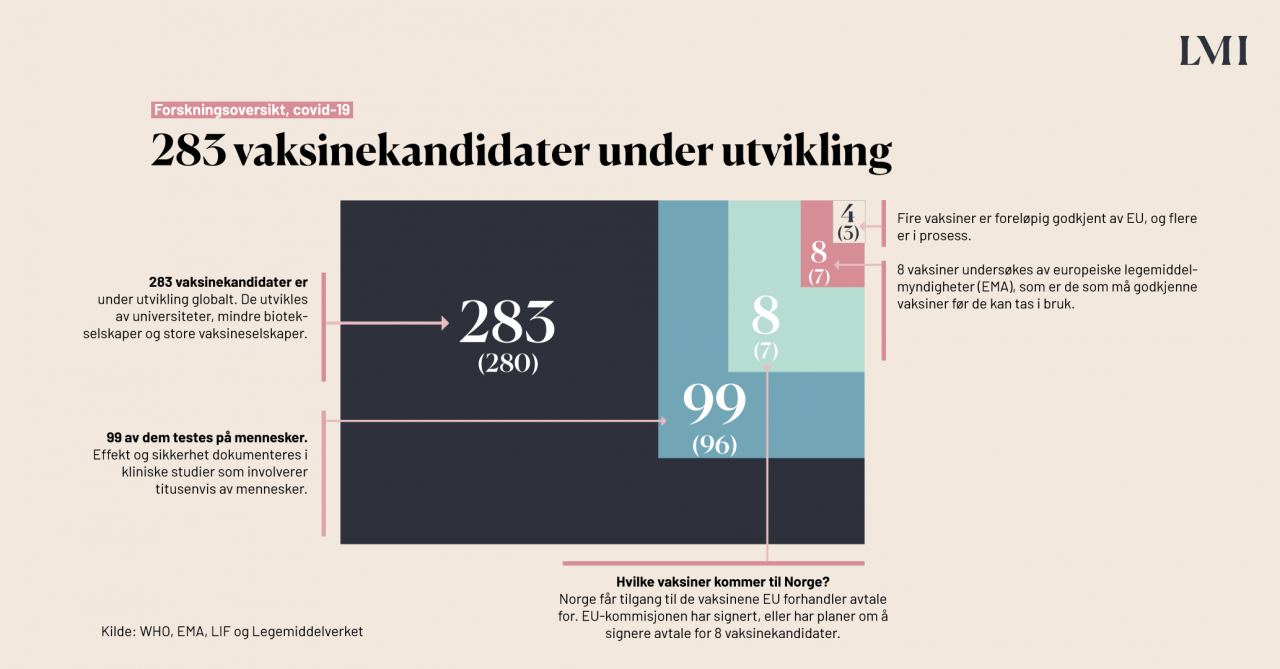
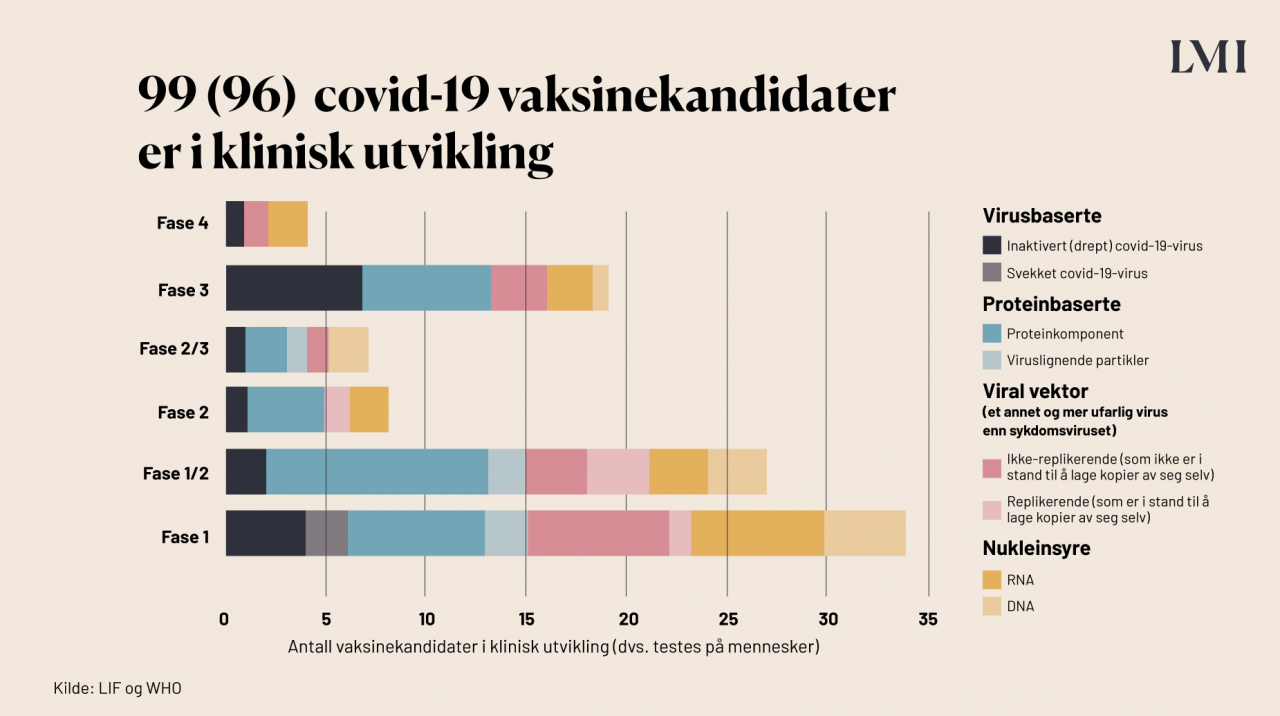
Hvor mange av vaksinekandidatene er i klinisk fase?
99 av de 283 vaksinekandidatene er i klinisk fase, altså i den fasen der de testes på mennesker. Vaksinene testes i tre kliniske faser. Man starter alltid med fase 1:
Fase 1 – Her gis første dose til noen titalls frivillige deltagere, for å vurdere sikkerheten av vaksinen. Det gis forskjellige styrker for å finne ut hvilken dose som er nødvendig.
Fase 2 – Her undersøkes sikkerhet og effekt (virkning) hos flere hundre frivillige deltagere i ulike aldersgrupper og med ulik helsetilstand.
Fase 3 – Her testes vaksinen i store kontrollerte studier på mange tusen frivillige deltagere, for å finne ut om vaksinen beskytter mot sykdommen man vaksinerer mot, og for å samle informasjon om bivirkninger. Flere av koronavaksinene testes på alt fra 3000 til 90 000 personer.
Hvordan godkjennes vaksinene – og er de sikre?
Det er det europeiske legemiddelkontoret (EMA) som godkjenner en vaksine etter å ha vurdert nytte og risiko på grunnlag av de kliniske studiene. Alle legemidler og vaksiner kan gi bivirkninger, men de fleste er milde og forbigående. Som Statens legemiddelverk skriver på sine nettsider:
Selv om alvorlige bivirkninger av vaksiner er sjeldent, kan noen bivirkninger oppdages først når vaksinen tas i bruk av større og mer sammensatt grupper enn i studiene. De som vaksineres kan ha ulike sykdommer og mange tar andre legemidler samtidig. Dette kan ha betydning for hvilke bivirkninger som kan oppstå. Derfor er det viktig at vaksiner overvåkes så lenge de er i bruk.
Statens legemiddelverk
Vaksinene blir bare godkjent dersom de store studiene dokumenterer at nytten er større enn risikoen.
– Dersom studiene har 3000 studiedeltakere, regner man med å oppdage de mer sjeldne bivirkningene med en forekomst på 1 av 1000
– Dersom studiene har 30 000 studiedeltakere, regner man med å oppdage svært sjeldne bivirkninger med en forekomst 1 av 10 000, skriver Statens legemiddelverk.
– Koronavaksinestudiene som har kommet lengst har i gjennomsnitt 56 000 studiedeltakere.
Eventuelle bivirkninger som først oppstår lang tid etter vaksineringen, fanges opp i den kontinuerlige bivirkningsovervåkingen som er felles for alle vaksiner og legemidler. Dersom det da kommer flere meldinger om samme bivirkning, må myndighetene gjøre en vurdering. Hvis bivirkningen mest sannsynlig skyldes vaksinen, er det behov for tiltak, for eksempel råd om hvem som ikke bør få vaksinen. I sjeldne tilfeller kan vaksinen bli trukket fra markedet.
Hvilke vaksiner har kommet lengst?
EMA har godkjent fire vaksiner: Pfizer og BioNTechs Comirnaty, Modernas vaksine Spikevax (som først hadde det midlertidige navnet Covid-19 Vaccine Moderna), AstraZeneca/Oxford Universitys vaksine Vaxzevria (som først hadde det midlertidige navnet Covid-19 Vaccine Astra Zeneca) og Janssens vaksine Vaccine Janssen.
Alle de godkjente vaksinene har vært i en prosess hos EMA som kalles «rolling review», noe som betyr at legemiddelmyndigheten vurderer dataene etter hvert som de blir klare. Vanligvis krever de at legemiddelfirmaene har alle data klare før man starter godkjenningsprosessen, men det gjøres unntak når det er snakk om alvorlig trussel mot folkehelsen.
Per august 2021 er fem vaksiner under rolling review hos EMA:
- NVX-CoV2373 (Novavax)
- CVnCoV (CureVac)
- Sputnik V (Gam-COVID-Vac) (Russia’s Gamaleya National Centre of Epidemiology and Microbiology)
- COVID-19 Vaccine (Vero Cell) Inactivated (Sinovac Life Sciences)
- Vidprevtyn (Sanofi Pasteur)
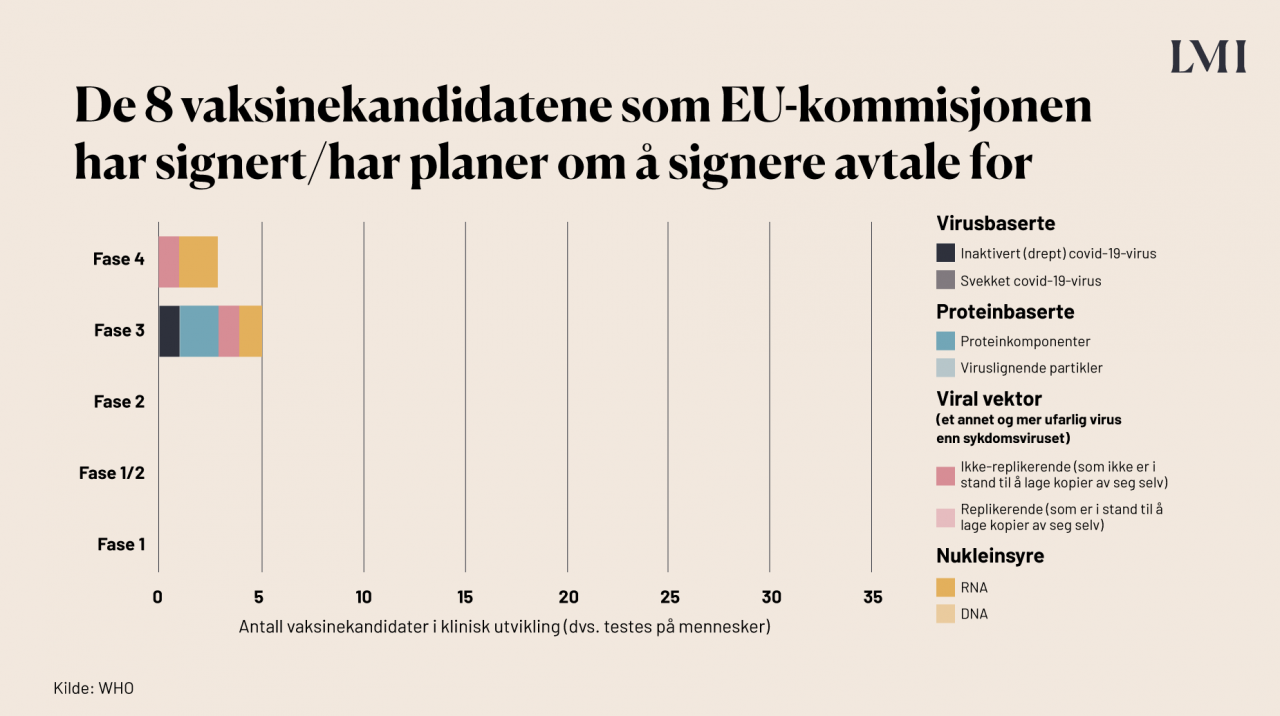
Hvilke vaksiner mot covid-19 er aktuelle for Norge?
I EU er det EU-kommisjonen som forhandler med vaksineprodusentene om å levere vaksiner til medlemslandene. EU-kommisjonen har i øyeblikket gjort avtale med produsentene av 8 ulike vaksinekandidater, ifølge LIF, og Norge får tilgang til de samme. Her er en oversikt over hvilke typer vaksiner dette er, samt hvilken fase de befinner seg i.
Hvor mange mennesker inngår i de kliniske utprøvningene?
Kliniske studier innebærer at den nye medisinen eller vaksinen testet på et stort antall frivillige personer, slik at man kan fange opp både effekt og bivirkninger. For de 7 kandidatene som EU har forhandlet/forhandler med, har i gjennomsnitt 55 000 personer vært involvert:
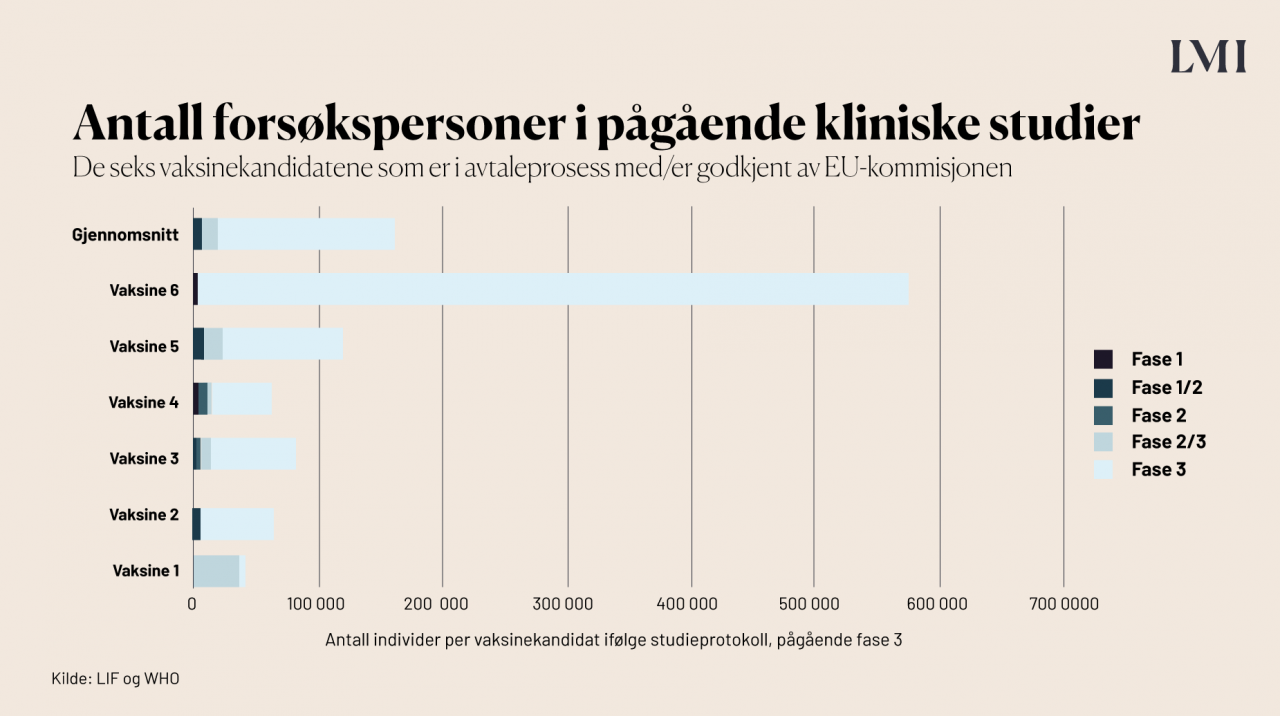
Hvor mange deltar vanligvis i vaksinestudier?
Ifølge tall fra WHO og LIF har i gjennomsnitt 26 500 personer deltatt i vaksinestudiene for pneumokokksykdom, helvetesild, HPV og japansk encefalitt, med en variasjon fra 5000 til rundt 43 000.
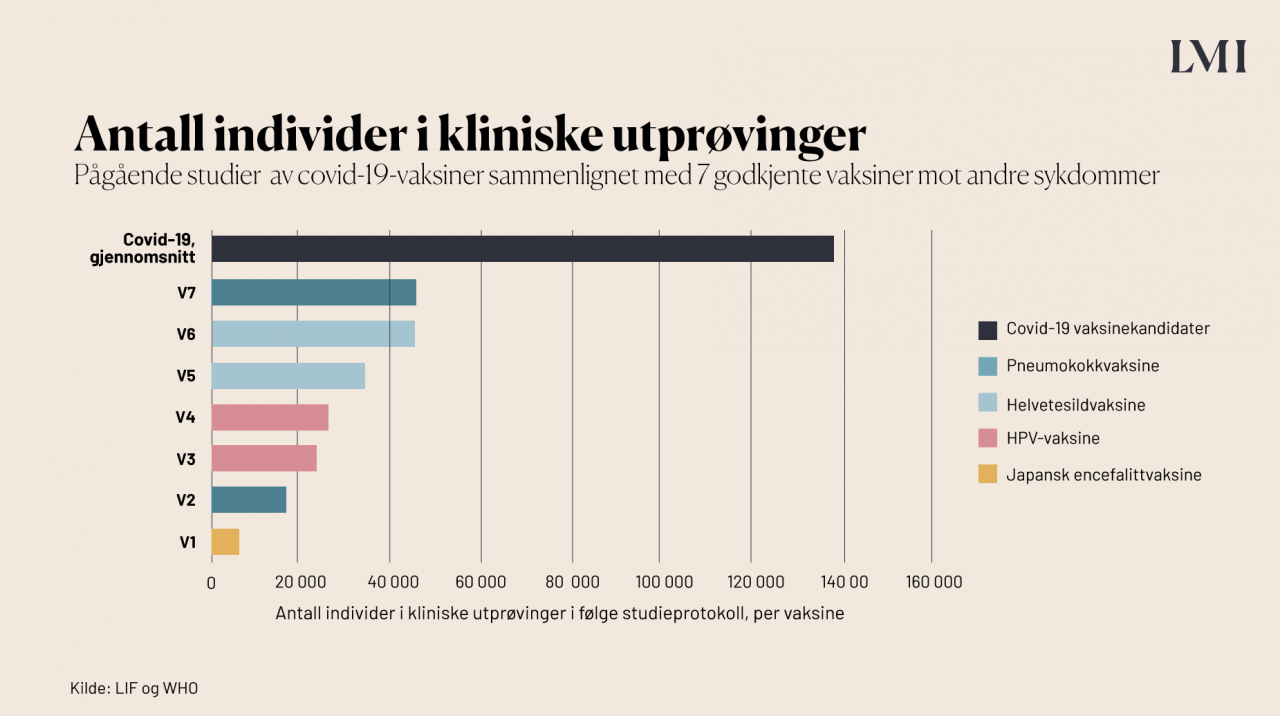
Er vaksinene testet på eldre personer?
Eldre har en noe økt risiko for alvorlig forløp dersom de rammes av covid-19. Dermed er det viktig at vaksinene som utvikles har god effekt nettopp på eldre. Ifølge EMA er Pfizer/BioNTechs vaksine testet på personer over 75 år, Modernas vaksine er testet på personer opp til 94 år, og AstraZeneca/Oxford Universitys vaksine er testet på personer i alderen 18 til 55. Statistikken fra LIF viser antall eldre (over 55 år) som er inkludert i studiene til de vaksinene som er aktuelle for EU og Norge.
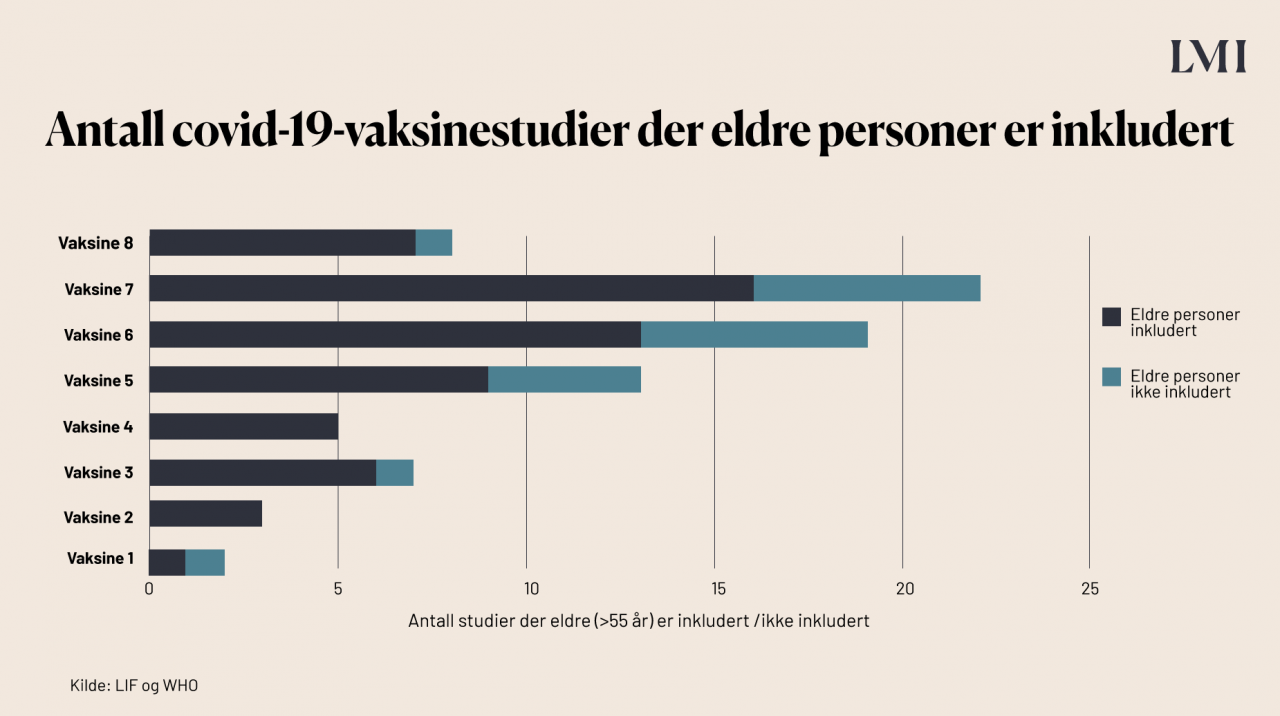
Hvordan kan det gå så raskt nå, når det vanligvis tar mange år å utvikle vaksiner?
Det er mange grunner til at man nå kan utvikle koronavaksiner veldig hurtig og på en trygg måte:
– Det pågår et utstrakt samarbeid mellom akademia, legemiddelprodusenter og myndigheter.
– Mange av prosessene utføres nå parallelt i stedet for i sekvens, slik man vanligvis må gjøre. Eksempelvis starter legemiddelfirmaene produksjon av vaksine før resultatene av kliniske studier er klare, og myndighetene evaluerer dokumentasjonen etter hvert som den blir tilgjengelig, i motsetning til at firmaene må samle opp til de har en komplett dokumentasjonspakke før de kan søke.
– De kliniske studiene kommer også raskere til en konklusjon når det er høy sykdomsaktivitet i samfunnet.
– I tillegg er enkelte av vaksinene utviklet med en relativt ny teknologi som gjør at de kan utvikles og produseres raskere enn tradisjonelle vaksiner; Vaksiner med levende virus som må dyrkes i celler tar lengre tid å produsere (6 mnd – 2 år) enn de nye RNA-vaksinene, som tar rundt 3 måneder.
Kravene til kvalitet, sikkerhet og effekt er akkurat de samme som for andre vaksiner og legemidler. De settes ikke lavere for de kommende koronavaksinene.
Kilde/referanser
LIF – legemiddelindustriforeningen i Sverige