Det er den europeiske legemiddelindustriforeningen, EFPIA, som bestiller den årlige rapporten, Waiting to Access Innovative Therapies (WAIT) om tilgang til legemidler i Europa. Rapporten har blitt utgitt siden 2004 og er den største europeiske studien som omhandler tilgang til legemidler og tiden det tar før pasienter får tilgang. Rapporten viser nøkkeltall for det europeiske tilgangsmiljøet for innovative medisiner på tvers av fem kohorter av medisiner (alle medisiner, onkologi, sjeldne medisiner, ikke-onkologiske medisiner og kombinasjonsterapier).
Rapporten inkluderer data fra 37 land (27 EU og 10 ikke-EU), og gir et fullstendig europeisk bilde av tilgjengelighet. Informasjon om de 168 innovative legemidlene med sentral markedsføringstillatelse mellom 2018 og 2021 er inkludert, og studien kjører med ett års forsinkelse for å tillate land å inkludere disse legemidlene på sin offentlige refusjonsliste, noe som betyr at dataene om tilgjengelighet er nøyaktige per 5. januar 2023.
Årets hovedfunn fra rapporten:
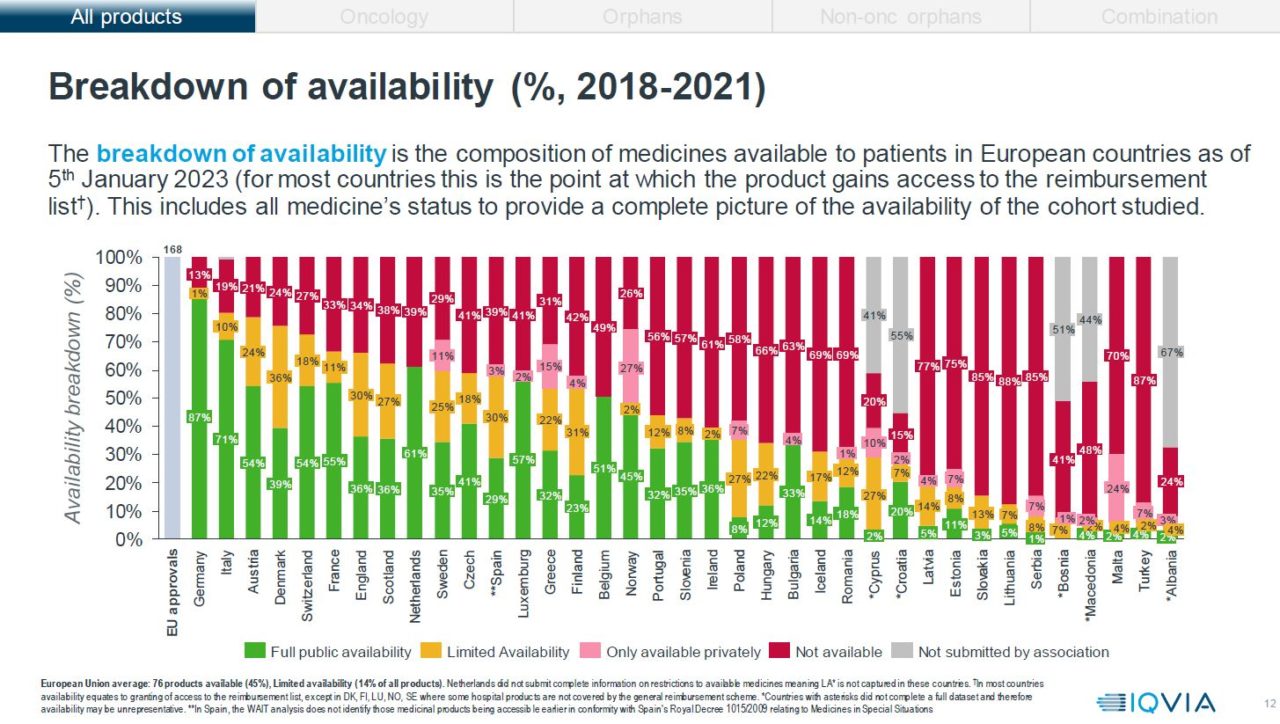
Tallene fra årets rapport viser at Norge har en negativ utvikling når det gjelder andel tilgjengelige legemidler. Tilgjengelighet i denne rapporten er definert som godkjent for offentlig finansiering, enten via folketrygden eller spesialisthelsetjenesten. 47 % av alle nye medisiner som er godkjent i Europa, mellom 2018 og 2021, er tilgjengelige i den offentlige helsetjenesten i Norge. Norge plasseres på en 17. plass, av 37 land, i Europa og havner dermed bak land som Danmark, Sverige, Finland, Nederland, Italia, Tsjekkia og Hellas. Fjorårets tall viste 52 % tilgjengelighet i Norge (83 legemidler).
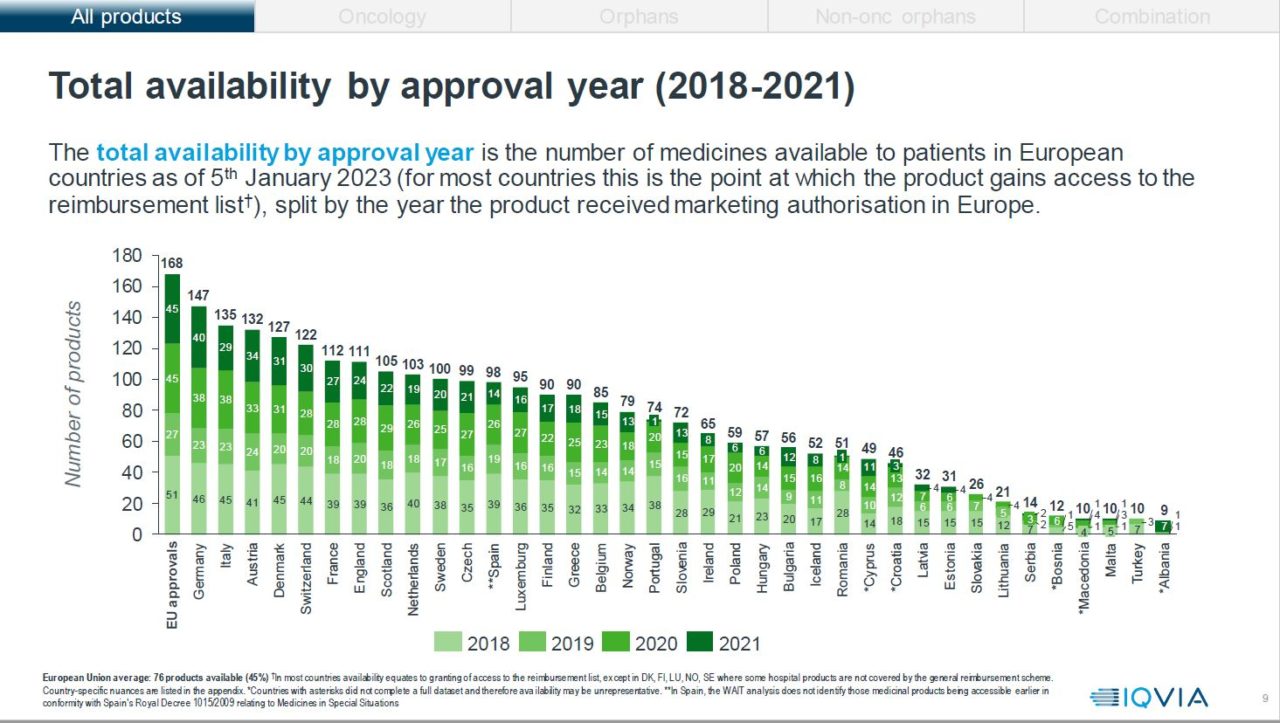
Tiden det tar fra et legemiddel har fått EMA-godkjennelse til det er godkjent for offentlig finansiering i Norge har økt fra i fjor. Norge bruker i snitt 443 dager på å godkjenne et nytt legemiddel, statistikken i fjor viste at vi brukte 414 dager, dette gir en økning på 29 dager.

Tilgjengelighet i det private markedet:
Norge er, som i fjor, på toppen av listen når det kommer til andelen legemidler (27 %) som kun er tilgjengelig på det private markedet. Etter Norge følger Malta med 24 % og Sverige med 11 %. Hvor mange av disse legemidlene som faktisk er tatt i bruk av pasienter finnes det ikke data på i denne analysen.
Kreftlegemidler:
Kun 52 % av alle kreftlegemidler som er godkjent i Europa, i perioden 2018-2021, er tilgjengelig i Norge. Det tar 542 dager fra et kreftlegemiddel er godkjent i Europa før det er godkjent av det offentlige helsevesenet i Norge. Til sammenligning tar det 145 dager i Danmark, 325 dager i Sverige og 351 dager i Finland.

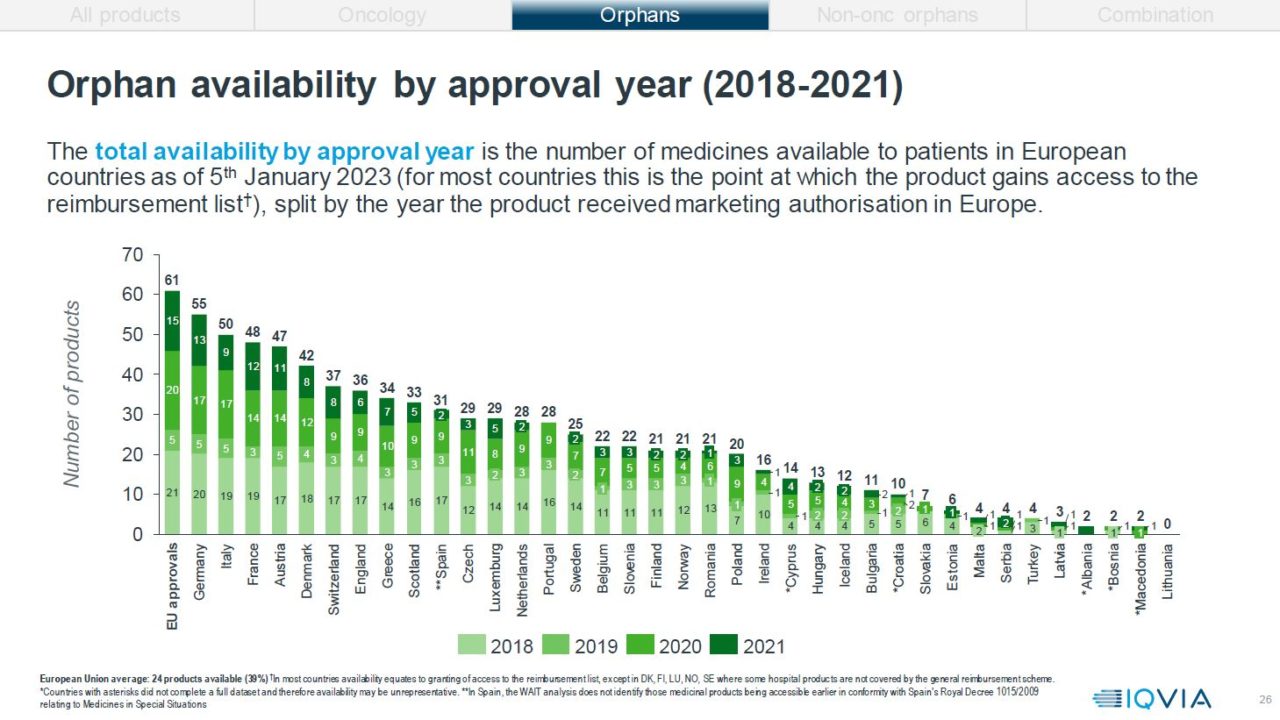
Orphan (sjeldne sykdommer):
Det er kun 34 % av alle EMA-godkjente legemidler til behandling av sjeldne sykdommer som er godkjent for offentlig finansiering i Norge, det gir Norge en 19. plass i Europa. Kun to legemidler innen denne kategorien ble godkjent for offentlige finansiering i 2021, til sammenligning ble 12 godkjent i 2018.
Det er bransjeforeningene for legemiddelindustrien i de ulike landene som har bidratt med innhenting av tall, LMI har sendt inn tall fra Norge. Tallene er hentet fra Nye metoder og Statens legemiddelverk. Rapporten ser på antall nye legemidler (substanser) godkjent av European Medicines Agency (EMA).
Les rapporten i sin helhet her.
Les også: Industriinitiativ gir nytt kunnskapsgrunnlag om årsaker til forsinkelser