Rapporten lages for tredje året på rad av analyseselskapet IQVIA. WAIT-rapporten, som ble publisert tidligere i år, ser på tilgang i Europa og definerer tilgang som når et legemiddel får refusjon i hvert land. Rapporten har mottatt kritikk for denne metodikken da den sammenligner land med ulike finansieringssystemer. Dette var bakgrunnen for at LMI ønsket en analyse med en annen metodikk der tilgang defineres som når legemiddel har blitt solgt første gang uavhengig av refusjon.
– Vi ønsker å ha flere analyser tilgjengelig med ulik metodikk, slik at vi best mulig kan vise tilgangssituasjonen i Norge, og utviklingen over årene, sier seniorrådgiver i LMI, Karoline Knutsen.
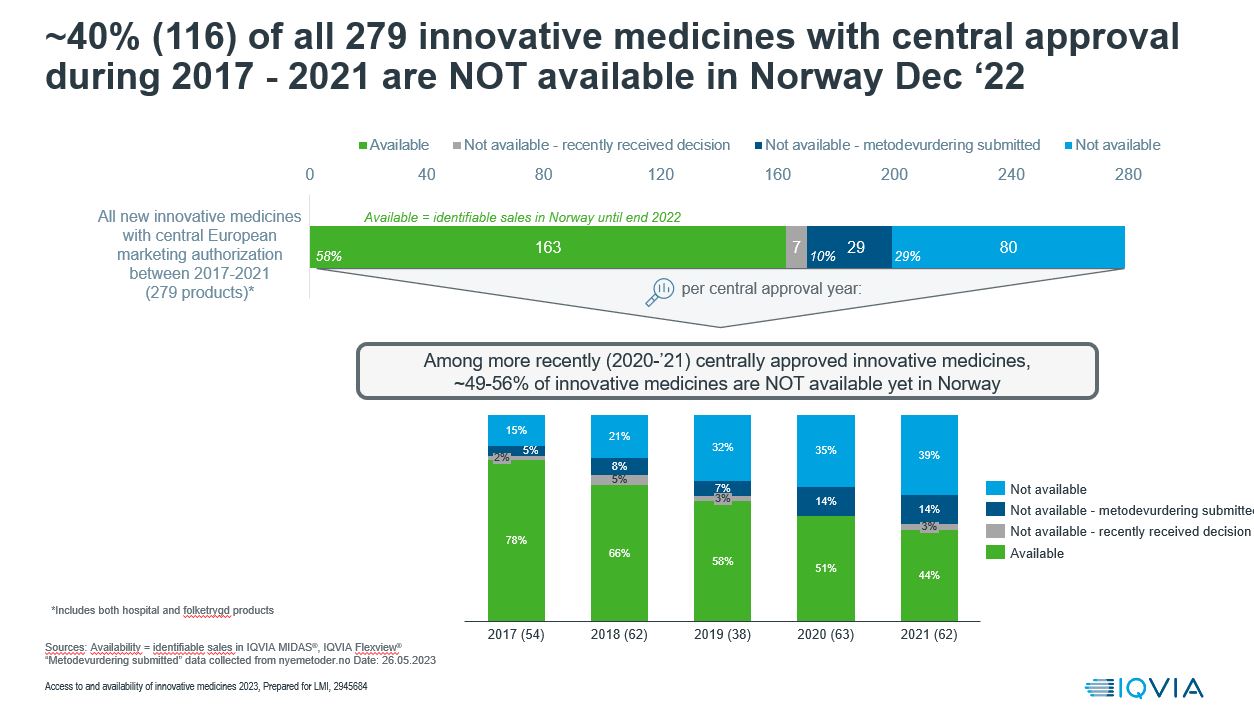
Hovedfunn fra rapporten viser at 58 % av nye legemidler i sykehusene, i perioden 2017-2021, er tilgjengelig i Norge. Det er innen terapiområdene onkologi og sjelden at flest legemidler ikke er tilgjengelige, her er også innovasjonen størst.
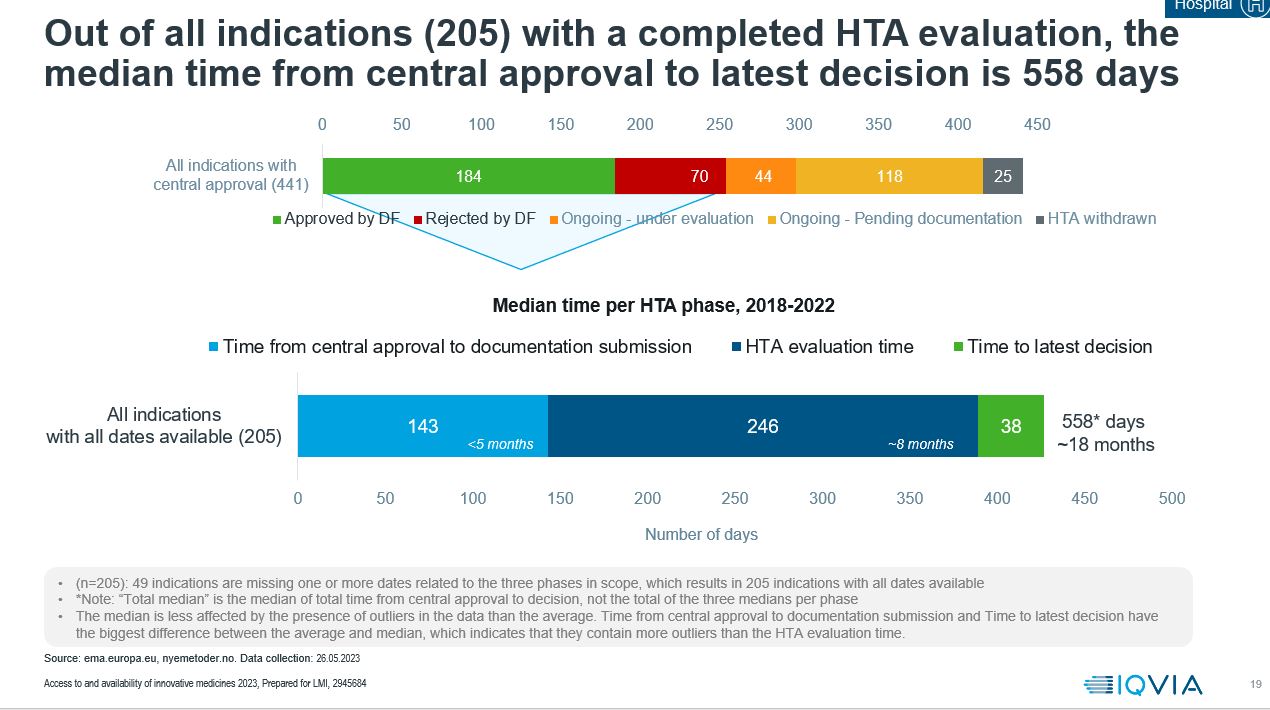
Tiden det tar fra et legemiddel har fått European Medicines Agency (EMA)-godkjennelse til det blir godkjent i Norge øker fremdeles. Mediantiden er på 558 dager, i forrige rapport var mediantiden på 445 dager.
Når det gjelder legemidler som er finansiert gjennom folketrygden, er mediantiden 428 dager, og Legemiddelverket bruker i snitt 171 dager på metodevurderinger. Her holder de seg godt under målet på 180 dager.
– Dette viser at det burde være mulig å korte ned saksbehandlingstiden i Nye metoder tilsvarende legemidler finansiert av Folketrygden. Dette kan vi også strekke oss etter når det gjelder godkjenning av nye behandlinger i Nye metoder, sier Knutsen.